硅表面常用的HF-HNO3-H2O蚀刻混合物的反应行为因为硫酸加入而受到显著影响。HF (40%)-HNO3 (65%)-H2SO4 (97%)混合物的最大蚀刻速率为4000–5000 NMS-1,w (40%-HF)/w (65%-HNO3)比为2比4,w (97%-H2SO4)<0.3.对于较高浓度的硫酸,H2SO4可视为稀释剂。为了研究硫酸在恒定HF和硝酸量下的影响,使用发烟硝酸(100%),并且混合物中的水依次被H2SO4代替。发现硫酸浓度约为6mol·L-1时,蚀刻速率突然增加,这与蚀刻溶液的特征颜色有关。大于7mol·L-1 h2so 4时反应速率降低是由于高溶液粘度和氟磺酸的形成。通常,在HF-HNO3-H2SO4/H2O蚀刻混合物中,硝酸的解离减少,硝基离子的形成,中性氮中间体的溶解度(例如。NO2、N2O3)以及其他效应影响硅表面的侵蚀。用扫描电子显微镜和激光扫描显微镜(LSM)研究了腐蚀硅表面的结构,硫酸的相对量对形貌影响最大。
HF-HNO3-H2SO4蚀刻混合物对晶体硅表面的整体反应性:略
硫酸浓度对二氧化氮+和N(III)物种蚀刻速率和形成的影响:图5显示了硅蚀刻速率、硫酸浓度与氢氟酸和硝酸混合物每溶解硅量产生的亚硝酸盐离子量之间的相关性。N(III)物种通过增加硫酸浓度来稳定。在传统的HF-HNO3-H2O蚀刻混合物中,大量的含氮化合物,如硝酸、NO3−、二氧化氮、NOx+和NO,使N(III)物种的反应性研究复杂化。最近研究的HF-NOHSO4-H2SO4蚀刻混合物是合适的模型蚀刻系统,因为N(V)和N(IV)物种是先验不存在的。对于这些混合物,我们发现亚硝基离子浓度的增加会导致硅蚀刻速率的增加。根据这些结果,大量的N(III)物质加速了HF-HNO3-H2o和HF-HNO3-H2so4混合物中的反应速率。用hf-hno3基混合物蚀刻硅后,得到了N(III)种类。

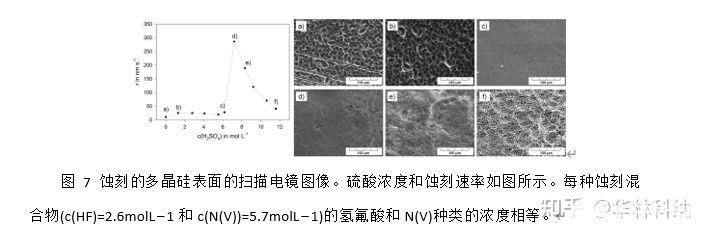
在HF(40%)-硝酸(100%)-硫酸(97%)/水蚀刻系统中,增加硫酸部分(诱导N(III)物种的稳定)不会导致硅蚀刻速率的线性上升。 5).而从0到5molL−1h2so4观察到恒定的蚀刻速率20-40nms−1,在6molL−1硫酸左右突然增加。这大致与蚀刻溶液从无色到绿色/蓝色的变化相关。在硫酸浓度高于7molL−1时,这些颜色消失,含有9molL−1硫酸的溶液也为无色。这意味着较高浓度的彩色物种,如二氧化氮(黄棕色)或三氧化二氮(蓝色)是导致蚀刻率突然增加的原因。随着硫酸浓度进一步增加到7molL−1以上的降低也是意料之外的,可以用假设N(III)物种的稳定和减少硝酸解离的影响通过增加蚀刻混合粘度来补偿。在HF-HNO3-CH3碳混合物中,蚀刻速率随着粘度的增加而降低。
对于传统的HF-HNO3-H2O混合物,蚀刻硅表面的结构取决于混合物的组成。在富含HF的溶液中,反应控制过程导致形成典型的椭圆形蚀刻坑。表面缺陷,如晶界或位错线,作为蚀刻反应的起点。大量的硝酸加速硅氧化导致表面光滑。在这些混合物中,含氟物质(F−、HF、HF2−)在硅表面的扩散被认为是限速步骤。因此,不均匀性的区域优先蚀刻,导致抛光表面。
利用扫描电镜和激光扫描显微镜研究了HF-HNO3-H2SO4混合物中蚀刻硅片的表面结构。图7显示了用几种不同浓度的硫酸获得的蚀刻多晶硅表面的扫描电镜图像。硫酸浓度c(h2so4)=0.0-11.6moll−1的增加对表面结构的影响较大。
原始HF-HNO3-H2SO4蚀刻混合物(与硅接触前)的表征:略
在传统的HF-HNO3-H2O蚀刻混合物中加入硫酸,导致硝酸的解离减少,形成硝基离子。对于高硫酸浓度和低水含量,通过14n核磁共振和拉曼光谱验证了硝基离子的形成。在1400cm−1下整合二氧化氮+拉曼线强度,可以定量HFHNO3-h2so4溶液中的硝基铵离子。
在HF-HNO3-H2SO4蚀刻混合物中,硅的蚀刻速率取决于几个参数。当硫酸浓度为6molL−1时,硅的溶解突然增加,这主要是由于增加未解离的硝酸、硝基离子和/或NOx物质如二氧化氮的浓度而加速硅氧化引起的。对于非常高的硫酸浓度,增加了溶液的粘度,氟硫酸的产生降低了硅的蚀刻速率。用离子色谱法证实了亚硝酸、三氧化二氮或NO+等N(III)种的形成。此外,通过紫外/Vis光谱法证明了在稀释的HF-hno3-h2o混合物中存在亚氮酸作为一种额外的反应产物。
亚氮酸和亚硝基离子可以分别通过同时从硅表面的2e−转移到硝酸和硝基离子而产生。或者,二氧化氮可以通过1e−还原二氧化氮+和/或三氧化二氮解离形成中间产物。
在富含H2SO4的溶液中有孔状蚀刻坑的形成。这与众所周知的基于HF-HNO3溶液的硅蚀刻模式的原理不一致。显然,在硅/电解质界面上的单个反应步骤受到高硫酸浓度的显著影响。硅表面末端分析和氢末端硅表面的模型反应目前用于解决高频-hno3溶液中整体蚀刻过程的单个反应步骤。
![]()

